Potencial de Ionización

1er Potencial de ionización:
Energía necesaria para arrancar un e- de un átomo
aislado en fase gaseosa en su estado fundamental y obtener un ion monopositivo gaseoso en su estado
fundamental más un electrón sin energía cinética. Siempre se les asigna un valor positivo, por tratarse de una
reacción endotérmica.

2º Potencial de ionización:
Energía necesaria para arrancar a un ion monopositivo gaseoso en estado
fundamental y obtener un ion dipositivo en las mismas condiciones mas un electrón sin energía cinética.

Energía de ionización total
para llegar a un ion determinado es la suma de los sucesivos potenciales de ionización.
-
Las energías de ionización miden, por tanto, la fuerza con que el átomo retiene sus electrones. Energías
pequeñas indican una fácil eliminación de electrones y por consiguiente una fácil
formación de iones positivos.
-
Los potenciales de ionización sucesivos para un mismo elemento crecen muy deprisa, debido a la dificultad
creciente para arrancar un electrón cuando existe una carga positiva que le
atrae y menos cargas negativas que le repelan.
- El conocimiento de los valores relativos de las energías de ionización sirve para predecir si un elemento
tenderá a formar un compuesto iónico o covalente
|
Energía de ionización |
Tendencia del elemento |
Tipo de compuesto |
|
Baja |
Perder electrones y dar iones positivos |
Iónicos |
|
Elevada |
Compartir electrones |
Covalentes |
|
Muy elevada |
Ganar electrones y dar iones negativos |
Iónicos |
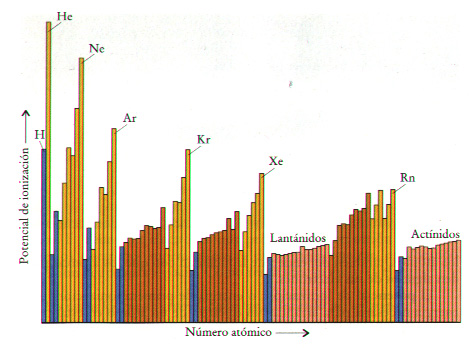
Variación periódica:
- Dentro de una familia, el aumento del
número de electrones tiende a reducir el potencial de ionización debido a los
efectos combinados del tamaño y de efecto pantalla. Al descender en un grupo,
se obtienen átomos más voluminosos en los que los electrones están menos
retenidos, por lo que el potencial de ionización decrecerá.
- En un periodo tiende a aumentar al
hacerlo el número atómico. En principio, la tendencia que cabria esperar es
que al aumentar la carga nuclear efectiva y no aumentar apenas el radio atómico,
la energía de ionización sea cada vez mayor.
- En cada segmento periódico, los gases
raros tienen las energías de ionización más elevadas. Estos gases son
elementos muy estables y sólo los más pesados de ellos muestran alguna
tendencia a unirse con elementos para dar compuestos.
|  |
Ejercicio propuesto
Con referencia a la tabla periódica, acomode los átomos siguientes en orden
de energía de primera ionización creciente: Ne, Na, P, Ar y K.
El orden se predice con base en la posición relativa de los elementos y las
tendencias en cuanto a variación de esta propiedad ya comentadas:
- Na, P y Ar están en la misma fila de la tabla periódica, por lo que P.I.Na<P.I.P<P.I.Ar.
- Ne y Ar son gases nobles. Puesto que el Ne presenta un menor número
atómico es esperable que P.I.Ar<P.I.Ne.
- De igual modo, el Na y el K son metales alcalinos, por lo que atendiendo a
su disposición en el sistema periódico, lo esperable es que P.I.K<P.I.Na.
- A partir de estas observaciones concluimos que las energías de
ionización siguen el orden P.I.K<P.I.Na<P.I.P<P.I.Ar<P.I.Ne.
(*) Aún no se han llevado a cabo medidas exactas de las
energías de ionización (ni de los pesos atómicos y otras propiedades)
de algunos elementos, especialmente los actínidos.
Algunos de ellos son radiactivos y otros son muy raros y es difícil
obtener una cantidad suficiente para efectuar determinaciones precisas.

