El tamaño de un átomo no es invariable sino que depende del entorno inmediato en el que se encuentre, de su interacción con los átomos vecinos.
Estimar el tamaño de los átomos es un poco complicado debido a la naturaleza difusa de la nube electrónica que rodea al núcleo y que varía según los factores ambientales. Se realizan las medidas sobre muestras de elementos puros no combinados químicamente y los datos así obtenidos son los tamaños relativos de los átomos.
| Radio atómico de un elemento es la mitad de la distancia entre los centros de dos átomos vecinos. | 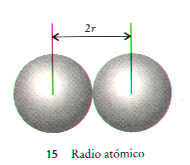 |
Los radios atómicos se indican a menudo en angstroms A 10-10m), nanómetros (nm, 10-9 m) picometro (pm, 10-12 m).
|
 |
Los radios atómicos aumentan en términos generales hacia abajo en un grupo y disminuyen a lo largo de un periodo.
Disponga los átomos siguientes en orden de radio atómico creciente: Na, Be y Mg
Una vez situados estos elementos en el sistema periódico se ha de hacer uso de las variaciones periódicas de esta propiedad ya comentadas.
Na (metal alcalino) y Mg (metal alcalino-térreo) se encuentran en la misma fila de la tabla periódica. Puesto que el Mg está a la derecha, lo esperable es que rMg<rNa.
Be y Mg se encuentran en la misma columna. Dado que el Mg está por debajo que el Be, es predecible que rBe<rMg.
Por tanto, el orden pedido sería: rBe<rMg<rNa.